04
Свойства меланина
Опубликовал: Petr_MSСвойства меланина, выделенного из пчелиного подмора
Меланины — это макромолекулярные, отрицательно заряженные соединения с гидрофобными свойствами и неопределенной молекулярной структурой. Меланины чрезвычайно широко распространены в природе и присутствуют в различных организмах, включая бактерии, грибы, растения, животных и человека. Будучи пигментами, они выполняют множество адаптивных функций: защита от ультрафиолета и радиации, хелатирование ионов металлов, выраженная антиоксидантная активность. Указанные свойства меланинов обусловливают их огромный биотехнологический потенциал. Применение этих высокомолекулярных веществ перспективно в косметологии, медицине, фармакологии, сельском хозяйстве, материаловедении и нанотехнологиях [3].
Из-за дороговизны, сложности выделения и очистки от примесей сфера меланинов весьма ограничена. Трудности выделения и очистки меланинов из биологических материалов и изучения их структуры связаны с тем, что все меланиновые пигменты являются аморфными веществами. Вследствие этого, а также из-за большого разнообразия путей их биосинтеза точная структура и функции многих меланинов до сих пор не выяснены и приведенные в литературе данные об их физико-химических свойствах в основном относятся к водонерастворимым диоксифенилаланин-меланинам [8]. Меланины получают химическим и микробиологическим синтезом, а также экстракцией из животного и растительного материала [5].
Объем сырья в виде погибших пчел (подмор) представляется достаточным для получения из него биологически активных веществ, в частности меланина. Так, объем подмора, пригодного для промышленной переработки, оценивается в десятки тонн в год из расчета содержания в России 3 млн пчелиных семей [2].
Цель настоящей работы — выделение меланина из пчелиного подмора и характеристика его физико-химических и биологических свойств. В качестве сырья использовали весенний подмор среднерусских медоносных пчел (Apis mellifera mellifera L), полученный в УНЦ «Экология и морфофизиология медоносной пчелы» ФГБОУ ВО «Пермский государственный аграрно-технологический университет им. академика Д.М.Прянишникова». Меланин из сухой и измельченной биомассы пчел получали путем экстракции 10%-ным раствором NaOH в соотношении 1:10. Сырье перемешивали при температуре 80...90°С без доступа воздуха в течение 1,5-2 ч. При этом происходило депротеинирование сырья.
Затем к смеси добавляли 50%-ный раствор NaOH и проводили дополнительный гидролиз уже в 30%-ном растворе NaOH при 90...95°С в течение 1,5-2 ч [6]. Охлажденную массу фильтровали через марлевый фильтр. К полученной щелочной смеси добавляли концентрированную соляную кислоту, доводя рН примерно до 3. Меланин в виде выпавшего хлопьевидного темно-коричневого осадка отделяли центрифугированием при 6 тыс. об/мин в течение 15 мин, после чего промывали подкисленной водой и вновь центрифугировали. Далее меланин высушивали до порошкообразного состояния на роторном испарителе. Оставшуюся после отделения меланина надосадочную жидкость можно использовать для выделения хитозана путем дальнейшего снижения рН.
Растворимость полученного меланина определяли в буферных растворах (10 мМ фосфатного буфера с рН 6,0-8,0). О растворимости судили по исчезновению гранул меланина в растворе и по спектру поглощения в диапазоне 200-400 нм (спектрофотометр UV-VIS Shimadzu). Защитные свойства меланина от действия ультрафиолетовых (УФ) лучей изучали с использованием бактерий Escherichia coli К-12 и Staphylococcus cohnii BKM-3165, выращенных в течение 16-18 ч на жидкой питательной среде. Затем готовили суспензии из отмытых бактерий, содержащих 108 колониеобразующих единиц (КОЕ) в 1 мл в 10 мМ буферного раствора с рН 7,8. В стерильную чашку Петри вносили 4,5 мл раствора меланина в указанном буферном растворе (концентрация 0,5 мг/мл) и добавляли 0,5 мл приготовленной суспензии бактерий Е. coli или S. cohnii.
В контрольном варианте вместо раствора меланина вносили буферный раствор. Суспензии бактерий в чашках Петри устанавливали под бактерицидную лампу (на расстоянии 50 см от нее), излучающую короткие УФ-лучи с пиком при длине волны 253,7 нм. Облучение проводили в течение 0, 15, 30 и 60 с при умеренном перемешивании. В указанные промежутки времени отбирали пробы для определения количества КОЕ методом последовательных десятичных разведений и высева на питательный агар [4].
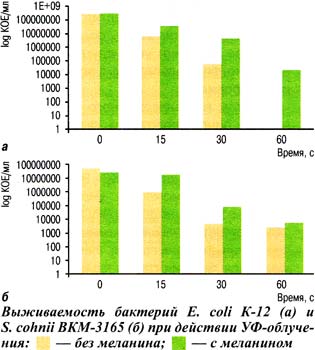
Меланин из пчелиного подмора хорошо растворялся в щелочных растворах с рН 7,8 и выше. При спектрофотометрии полученных растворов в УФ-спектре пик наблюдался при длине волны 210 нм, что соответствует поглощению фенола в щелочной среде [1]. Максимальное значение оптической плотности растворов меланина (0,1 мг/мл) при длине волны 210 нм соответствовало значению (1,4±0,25) при рН 8,0. Инкубация бактериальных клеток в растворе меланина способствовала более успешному их выживанию после воздействия УФ-облучения.
Результаты наших исследований показали, что бактерии Е. coli полностью погибают после облучения в течение 60 с. Такой же режим облучения снижает число жизнеспособных клеток S. cohnii на четыре порядка по сравнению с исходным их количеством. Присутствие меланина, выделенного из пчелиного подмора, существенно повышает выживаемость бактерий при действии УФ-облучения (рис.).
Так, в суспензии с меланином через 60 с УФ-облучения живых бактерий Е. coli оказалось более 104 КОЕ/мл, а живые бактерии S. cohnii превысили количество живых клеток контрольной пробы более чем в 2 раза. Защитная функция меланинов заключается в поглощении УФ-лучей, предотвращая повреждение клеток. Меланин функционирует как ловушка активных продуктов облучения и замедляет перекисное окисление липидов. В результате свободнорадикальные продукты, образующиеся при окислении липидов, инактивируются на меланиновои матрице и не выходят в окружающее пространство [7].
Таким образом, меланин, выделенный из пчелиного подмора, проявляет выраженные протекторные свойства, защищая бактерии от УФ-излучения. Требуется дальнейшее изучение физико-химических свойств полученного продукта и его влияния на живые организмы.
Т.В.ПОЛЮДОВА1, 2, М.К.СИМАНКОВ2, С.В.ЛИХАЧЕВ2
1Институт экологии и генетики микроорганизмов
УрО РАН, г, Пермь
2ФГБОУ ВО «Пермский государственный
аграрно-технологический университет
им. академика Д.Н.Прянишникова»,
кафедра экологии, г. Пермь
ж-л «Пчеловодство» №5, 2019 г.Литература
1. Гридяева Е.С., Котов В.В., Стекольников К.Е., Ненахов Д.В. УФ-спектроскопическое исследование состава гумусовых веществ // Сорбционные и хроматографические процессы. — 2006. — Т. 6. — № 3.
2. Немцев С.В., Зуева О.Ю., Хисматуллин Р.Г., Хисматуллин М.Р., Лариков В.В., Варламов В.П. Хитозан из подмора — новый продукт пчел // Пчеловодство. — 2001. — № 5.
3. Погарская Н.В. Технология получения хитозан-мела-нинового комплекса из подмора пчел и его применение в ветеринарии и медицине. — Ставрополь, 2013.
4. Полюдова Т.В., Лемкина Л.М., Коробов В.П. Селекция активных продуцентов катионного пептида варнерина под действием ультрафиолета // Вестн. Пермск. ун-та. Сер. Биология. — 2013. — № 3.
5. Прутенская Е.А., Васильев А.С, Лебедева Е.Ю., Сидоров А.И. Технологии получения меланинов // Вестн. ТвГТУ — 2017. — Т. 31. — № 1.
6. Селионова М.И., Погарская Н.В. Способ получения хитозан-меланинового комплекса из подмора пчел / Патент РФ 2382051.—2010.
7. Hung Y. — C, Sava V.M., MakanSX, Chen J., Hong M. — Y., Huang G.S.Antioxidant activity of melanins derived from tea: comparison between different oxidative states // Food Chemistry. — 2002. — V. 78. — № 2.
8. Solano F. Melanins: Skin Pigments and Much More-Types, Structural Models, Biological Functions, and Formation Routes // Department of Biochemistry and Molecular Biology В & Immunology. — 2014.