26
Протеолиз
Опубликовал: Petr_MSАктивность протеолитических ферментов у личинок трутней разного возраста
Протеолиз — один из ключевых процессов жизнеобеспечения, поставляющий строительный материал для синтеза белка. Однако концепция протеолиза как инструмента деградации белка в последние годы претерпела существенные изменения: протеолитические ферменты рассматриваются еще и как важнейший регулирующий фактор обмена веществ [1]. Все без исключения структурные белки, ферменты, многочисленные по спектру физиологического действия пептиды в той или иной степени подвержены действию протеолитических ферментов.
Другими словами, акт гидролиза пептидной связи приводит к появлению нового белка (пептида) с другими физико-химическими и биологическими свойствами, что само собой приводит к изменению качественных и количественных характеристик сообщества белковых молекул, надмолекулярных систем во времени и в пространстве, обеспечивая, таким образом, контроль над всем комплексом обменных процессов в живом организме.
В связи со сказанным, а также для понимания роли отдельных протеолитических ферментов в сложной цепи посттрансляционных превращений белковой молекулы большой интерес представляет изучение их в онтогенезе животных, в том числе и насекомых. Превращение белков в ходе онтогенеза насекомых включает в себя три основных процесса: деградацию запасных белков, промежуточный обмен возникающих при этом аминокислот и синтез на их основе новых белков личинок.
Белковый обмен на разных стадиях развития насекомых сопровождается не только полным распадом белковых тел, но и ограниченным протеолизом (Филиппович и др., 1992; Takahashi, Yamamoto, 1993; Ribolla, Debianchi, 1995; Liu et al., 1996), что определяет время жизни и судьбу каждого конкретного белка и задает направление перестройке метаболизма, обеспечивая тем самым контроль не только белкового обмена во времени и в пространстве, но и обмена веществ в целом. Таким образом, превалирующий интерес к протеолитическим ферментам в последнее время обусловлен, прежде всего их ролью в регуляции обмена веществ [1, 5, 6].
В работе исследована активность двух протеолитических ферментов, относительно хорошо изученных по целому ряду параметров у некоторых видов животных: катепсина D и трипсиноподобного фермента [2-4, 6]. О действии их у личинок трутней информация практически отсутствует.
В качестве объекта исследования использовали личинок трутней в возрасте 1-7 суток. Динамика активности исследуемых ферментов в онтогенезе быстрорастущих и активно развивающихся организмов, по нашему мнению, — адекватный показатель для выяснения их роли в процессе метаморфоза.
Большинство исследователей относят катепсин D к ферментам лизосомальной локализации, принимающим участие в реакциях неспецифического протеолиза. Трипсиноподобный фермент характеризуется чаще всего цитозольной локализацией. Считается, что он связан с ограниченным протеолизом, который характерен для посттрансляционной фазы превращения белков и пептидов [1, 5].
Из литературных данных известно, что рН-оптимум этих ферментов у насекомых отличается от рН-оптимума аналогичных ферментов у позвоночных животных [7], поэтому предварительно мы провели кинетический (подобрали уровни, оптимальные для действия ферментов, рН концентрации субстратов, продолжительность инкубации) и ингибиторный анализы.
Для исследования активности протеолитических ферментов использовали 10%-ный экстракт трутневых личинок: 1 г личинок гомогенизировали в 10 мл 0,9%-ного раствора NaCI, затем на рефрижераторной центрифуге в течение 30 минут при 10 000 об/мин отделяли оставшиеся неразрушенные клетки и субклеточные структуры, сливали супернатант, и в нем определяли активность ферментов. Все операции по составлению инкубационных смесей проводили на ледяной бане при температуре 5...7°С.
Субстратом для катепсина D служил 8%-ный гемоглобин; для трипсиноподобного фермента — N-α-бензоил-DL-аргинин-n-нитроанилид или БАПНА (0,4 мг/мл).
Для проведения опытов по изучению активности катепсина D в инкубационную среду, содержащую 120 мкл 0,1 М натрий-ацетатного буфера (рН=4,5), добавляли 40 мкл 10%-ного экстракта трутневых личинок, 40 мкл 8%-ного гемоглобина, перемешивали и на 40 минут помещали в водяной термостат при температуре 37°С. Реакцию останавливали добавлением 200 мкл 5%-ного раствора трихлоруксусной (ТХУ) кислоты. Пробы центрифугировали 20 минут при 4000 об/мин и отбирали 100 мкл супернатанта для проведения цветной реакции. Количество продуктов гидролиза гемоглобина определяли методом Лоури [8]. Из полученных величин оптических плотностей опытных проб вычитали величины оптических плотностей соответствующих контрольных проб, которые отличались от опытных тем, что ТХУ кислоту в них вносили перед добавлением субстрата.
При определении активности трипсиноподобного фермента к инкубационной среде, содержащей 300 мкл 0.05М фосфатного буфера (рН=10) и 250 мкл опытного экстракта, прибавляли 0,5 мл БАПНА; после 30 минут инкубации при 37°С реакцию останавливали добавлением 350 мкл 1 н. раствора HCI. В контрольные пробы кислоту вливали перед внесением субстрата. Количество образовавшегося а-нитроанилина определяли спектрофотометрически при длине волны 383 нм.
За единицу активности ферментов принимали такое их количество, которое катализирует высвобождение 1 мкмоля продукта реакции (α-нитроанилина для трипсиноподобного фермента и тирозина для катепсина D) за 1 минуту на 1 мг белка. Количество выделившихся веществ определяли по калибровочной кривой.
Статистическую обработку данных осуществляли с использованием программы Microsoft Excel 2010. Сравнение средних значений показателей проводили с использованием t-критерия Стьюдента, дисперсионного анализа и критерия U Манна-Уитни.
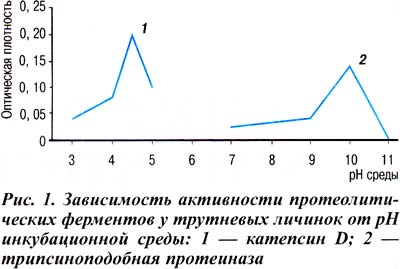
Для определения рН-оптимума действия протеолитических ферментов измерение их активности вели в диапазоне рН от 3,0 до 11,0. Полученные результаты (рис. 1) показали, что рН-оптимум действия катепсина D равен 4,5 и практически на единицу сдвинут в щелочную область в отличие от рН-оптимума действия этого фермента в тканях и органах позвоночных животных (Е. Пресс, 1960; Huang, Tappel, 1971). Показатель рН-оптимума действия трипсиноподобного фермента также сдвинут в щелочную область. Подобный феномен установлен для этого фермента ранее у других насекомых [6].
Для определения подклассовой принадлежности протеолитических ферментов использовали ингибиторный анализ с применением специфических ингибиторов для каждого из исследуемых в работе ферментов. Было установлено, что специфические ингибиторы (пепстатин для катепсина D и ингибитор Кунитца для трипсиноподобного фермента) незначительно подавляют активность названных ферментов — не более чем на 7-10%. Подобные данные были получены рядом исследователей у других насекомых [6].
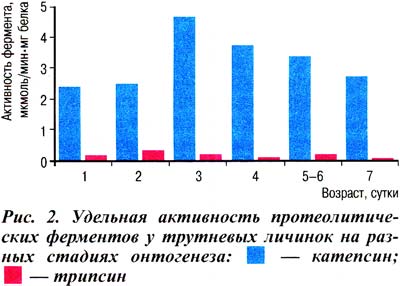
На рисунке 2 представлены результаты определения активности ферментов у трутневых личинок разного возраста.
Из рисунка видно, что активность катепсина D наименьшая и практически одинаковая у личинок одно- и двухсуточного возраста. На третьи сутки она резко увеличивается (в 2 раза) и затем постепенно снижается с четвертого по седьмой день, но достигнув минимума, остается выше исходного уровня.
По всей видимости, резкое увеличение активности катепсина D на третьи сутки связано с началом активизации процесса гидролиза эндогенных запасных белков с целью обеспечения личинки строительным материалом для синтеза новых белков. Активация катепсина D при тех или иных перестройках в организме разных животных отмечена в ряде работ других авторов [6].
Что касается трипсиноподобного фермента, то здесь выявлена более сложная картина изменения его активности в онтогенезе личинок трутней: обнаружена фазность в ходе процесса. Так, наивысшая активность фермента характерна для двухсуточных личинок (первая фаза усиления), где она в 2 раза выше активности фермента односуточных личинок; на третьи и четвертые сутки наблюдается постепенное, но существенное снижение активности до уровня 60% от исходной.
Далее на пятые-шестые сутки отмечаем вновь повышение активности фермента (вторая фаза усиления) и резкое снижение на седьмые сутки, когда активность становится минимальной и составляет 40% активности односуточных личинок. Видно, что динамика измения активности трипсиноподобного фермента у личинок ранней стадии развития частично повторяет картину изменения активности катепсина D и практически с равной амплитудой. Однако максимальный эффект трипсиноподобного фермента отмечается на вторые сутки, а катепсина D — на третьи.
Тем не менее в определенной степени и тот и другой фермент на ранних сроках личиночной стадии могут выполнять одинаковую функцию — освобождать аминокислоты за счет гидролиза эндогенных белков. Существенная активация трипсиноподобного фермента на пятые-шестые сутки, несомненно, связана с его специфическими функциями, например с закладкой органов и систем — процессом, характерным для личинок этого возраста. Хорошо известно, что трипсиноподобные ферменты — одни из ведущих ферментов генеза регуляторных пептидов [1, 5], и рост его активности на вторые и пятые сутки может сопровождаться образованием тех пептидов, которые участвуют в закладке и развитии органов имаго.
В личинках трутней идентифицированы два фермента, обладающие протеолитической активностью со специфичностью действия катепсина D и трипсина. Установлены рН-оптимумы работы этих ферментов, изучены некоторые кинетические параметры и проведен их ингибиторный анализ. Показана динамика изменения активности исследуемых ферментов в зависимости от возраста личинок, что свидетельствует о вовлечении их в процессы онтогенеза.
М.Т.ГЕНГИН, Ж.В.ГРИШИНА
Пензенский государственный университет
ж-л «Пчеловодство» №2, 2016 г.Литература
1. Генгин М.Т. Особенности структурно-функциональной организации и физико-химические свойства нелизо-сомальных пептидгидролаз мозга животных: дис... д-ра биол. наук. — Пенза, 2002.
2. Иванов В.Г. Белковый комплекс и протеолитические ферменты желточного содержимого грены тутового шелкопряда Bombyx mori L.: дис... канд. биол. наук. — М., 1985.
3. Коновалов Ю.Д. Свойства, локализация, роль и возможные пути регуляции активности протеиназ и амино-трансфераз в раннем онтогенезе рыб // Успехи современной биологии. — 1986. — Т. 101. — № 3.
4. Немова Н.Н. Внутриклеточные протеолитические ферменты у рыб. — Петрозаводск: КНЦ РАН, 1996.
5. Хомутов А.Е., Пурсанов К.А., Перепелюк З.В. Регуляторные пептиды: учеб. — метод, пособие. — Н. Новгород: Изд-во ННГУ, 2014.
6. Ярыгин Д.В. Изучение комплекса протеолитических ферментов и их белковых ингибиторов в грене тутового шелкопряда: дис. ... канд. биол. наук. — М., 2000.
7. Cho W.L., Tsao S.M., Hays A.R., Walter R., Chen J.S., Shigirevskaya E.S., Raikhel A.S.Mosquito cathepsin B-like protease involved in embryonic degradation of vitellin is produced as a latent extraovarian precursor // J. Biol. Chem. — 1999. — Vol. 274. — Iss. 19.
8. Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J.Protein measurement with the Folin phenol reagent // J. Biol. Chem.— 1951. —Vol. 193.—№ 1.
СВЕДЕНИЯ ОБ АВТОРАХ: Генгин Михаил Трофимович, д-р биол. наук, проф. кафедры «Общая биология и биохимия», e-mail: gengin07@yandex.ru, тел. 8-927-360-21-17; Гришина Жанна Валерьевна, аспирант кафедры «Общая биология и биохимия», e-mail: grinzanetk@ gmail.com, тел. 8-996-800-01-08.